« Si le nerf est irrité, pourquoi mobiliser le nerf lui-même ? » Bob Elvey
Une revue narrative (Ellis 2021) sur les techniques de mise en tension des nerfs vient d’être publiée dans le Journal of Manual & Manipulative Therapy.
Elle détaille les potentiels effets de ces techniques et discute de leur intérêt. Je reprendrais dans ce billet certains de leurs points de vue et je complèterais par d’autres références ne figurant pas dans leur article.
Ce billet commence par la présentation des techniques neurodynamiques, puis détaille le rationnel physiologique du concept, ensuite il aborde l’efficacité de ces techniques dans la prise en charge des problèmes de nerfs pour enfin conclure sur le cadre clinique de l’utilité de ces techniques.
Les tests neurodynamiques :
Les tests de provocation neurodynamiques sont généralement utilisés dans le cadre de la prise en charge des douleurs irradiantes.
Ces tests tentent de déterminer si les symptômes d’un patient sont liés à l’augmentation de la mécanosensibilité nerveuse (voir ci-dessous) :
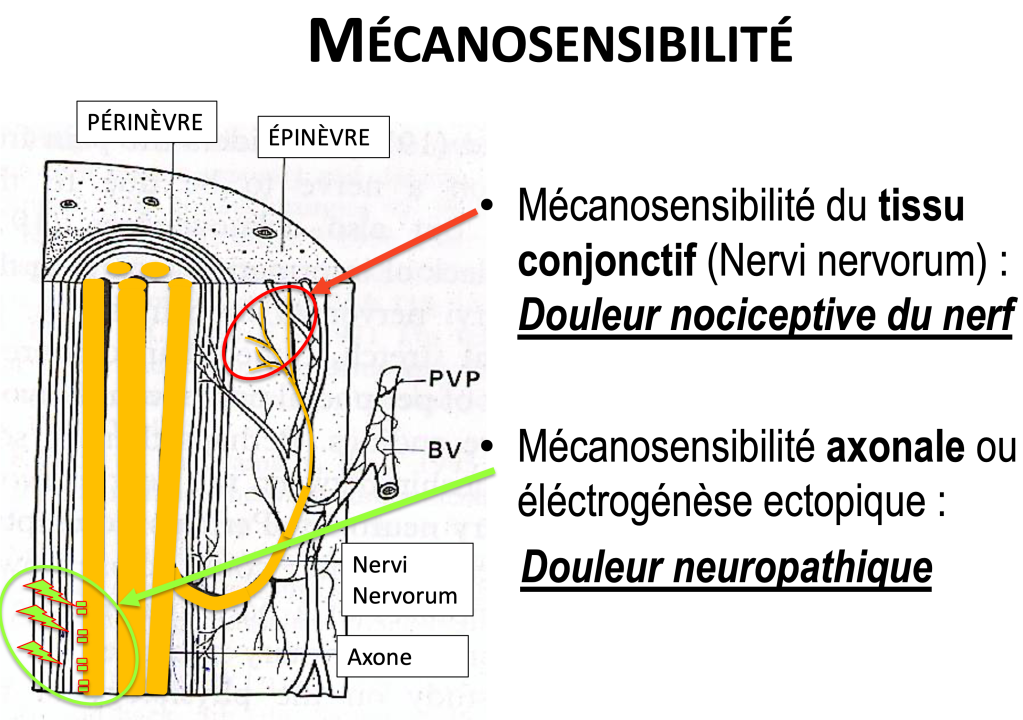
Ils mettent en place une combinaisons spécifiques de mouvements du rachis et des membres en appliquant des forces mécaniques à une partie du système nerveux (Coppieters et Nee 2015).
L’exemple ci-dessous (Walsh 2005) illustre la combinaison du test de provocation du nerf médian (Upper Limb Neural Provocation Test).
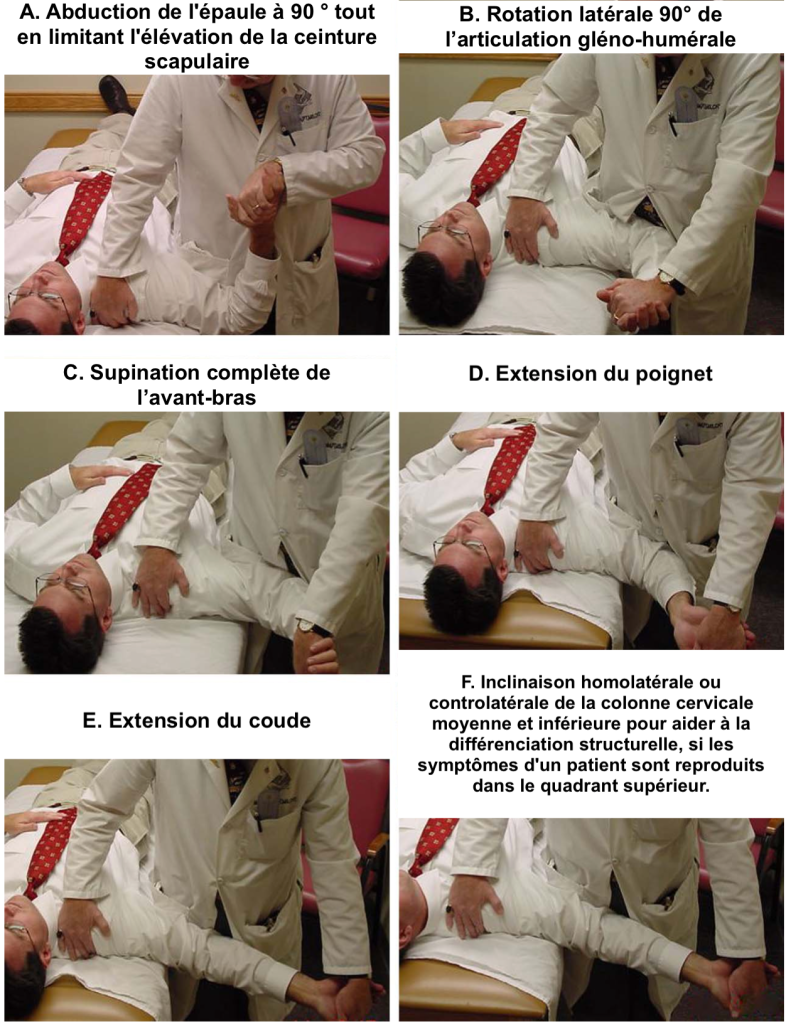
L’exemple du nerf médian ci-dessus, nous montre que d’autres structures non neurales sont mises en tension par cette manœuvre.
Il serait logique de penser que ces tests ne sont pas spécifiques du tissu neural.
Ceci étant la douleur produite par injection d’une solution saline soit dans le mollet, soit dans l’éminence thénar, n’est ni reproduite, ni augmentée en appliquant une différentiation structurelle au nerf médian (cadran F du schéma ci-dessus), au nerf sciatique ou au Slump test (Coopieters et al 2005, Coppieters et al 2006).
Ces données suggèrent que ces tests peuvent potentiellement être utilisés pour distinguer une douleur nociceptive musculaire, d’une douleur liée à l’augmentation d’une mécanosensibilité nerveuse.
Ces tests neurodynamiques ont fait l’objet de multiples études biomécaniques sur le tissu neural (in-vitro, in-vivo et ex-vivo), ainsi que d’études de fiabilité et de validité clinique (Coppieters et Nee 2015) qui permettent de les considérer utiles pour mettre en évidence uniquement la mécanosensibilité du SNP.
La prise en charge neurodynamique
Dans cadre du traitement des douleurs irradiantes les techniques neurodynamiques font référence aux méthodes thérapeutiques qui réduisent la charge sur le SNP tout en facilitant le mouvement entre les interfaces mécaniques et le SNP (Coppieters et Nee 2015) :
- Soit les techniques ciblent la mobilisation du nerf lui-même (par techniques de glissement : le ‘sliding’ ou ‘gliding’, ou par mise en tension : le ‘tensioning’) ;
- Soit, elles ciblent les interfaces mécaniques (Coppieters 2008).
L’indication de mobiliser le SNP et/ou les structures qui l’entourent dépend de nombreux facteurs : les mécanismes neurophysiologiques impliqués, l’irritabilité du SNP, le stade de guérison des tissus, la pathoanatomie, les réponses aux tests….
Les premiers cliniciens qui ont commencé à conceptualiser l’idée de mobiliser le système nerveux comme approche thérapeutique, ont créé des techniques qui ressemblaient aux tests neurodynamiques : les techniques de mise en tension ou de neurotension (les ‘tensioners’).
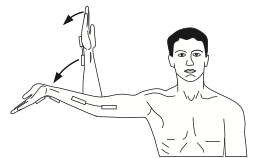
Un exemple de neurotension du nerf médian (figure ci-dessous) serait : en position de rotation latérale/abduction 90°, partir du coude fléchi, poignet fléchi, et de tendre le coude et le poignet :
Tensioning par Coppieters et al 2008
Certains cliniciens ont ensuite constaté que ces techniques pouvaient être agressives et ont développé le concept des techniques de neuroglissement : il s’agit ici de bouger deux articulations de telle sorte qu’un mouvement contrebalance l’augmentation de la tension nerveuse causée par un autre mouvement.
Un exemple de neuroglissement/sliding du nerf médian (figure ci-dessous) serait : en position de rotation latérale/abduction 90°, de partir du coude fléchi, poignet en extension, et de tendre le coude tout en fléchissant le poignet :
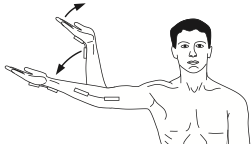
Sliding par Coppieters et al 2008
Lors des techniques de neuroglissement, il y a moins de contraintes de tension nerveuse alors que l’excursion du SNP par rapport aux structures environnantes est beaucoup plus importante (Coppieters 2008).
Le rationnel physiologique des techniques neurodynamiques :
Les suppositions physiologiques ont évolué avec le temps et la recherche.
Historiquement le paradigme de mise en tension des nerfs répondait à un raisonnement de causalité linéaire identique à celui des muscles trop tendus (ou pas assez souples) « causant » la douleur musculaire.
Ce raisonnement découlait de la réponse aux tests de mise en tension du nerf. Ceux-ci en plus de provoquer de la douleur, mettait en évidence une restriction de mobilité le long de la course du nerf, induisant ainsi le postulat que le nerf a un problème de « tension » ou de « glissement ».
Schaclock 2005, décrit les termes de ‘dysfonction de tension neurale’ et de ‘dysfonction de glissement neural’ étant la cause du problème de nerf. Pour traiter la douleur et le problème de nerf, la solution serait de traiter la « dysfonction » d’élasticité ou de mobilité en tirant dessus ou en redonnant du glissement.
Plusieurs études mettent en évidence que la restriction de mouvement détectée lors des tests n’est pas due à un défaut de compliance du nerf (dysfonctionnement de tension ou de glissement) mais est due à la protection du nerf par une réponse musculaire (Hall 1998, Balster 1997, Coppieters 1999, vanderHeide 2001). On abandonne le terme de Test de Tension Neural pour le terme de Test de Provocation Neural (Schmid 2018).
A ce jour, il n’existe aucune relation de causalité linéaire entre une « dysfonction » de compliance nerveuse et un trouble du système nerveux périphérique (Walsh 2011).
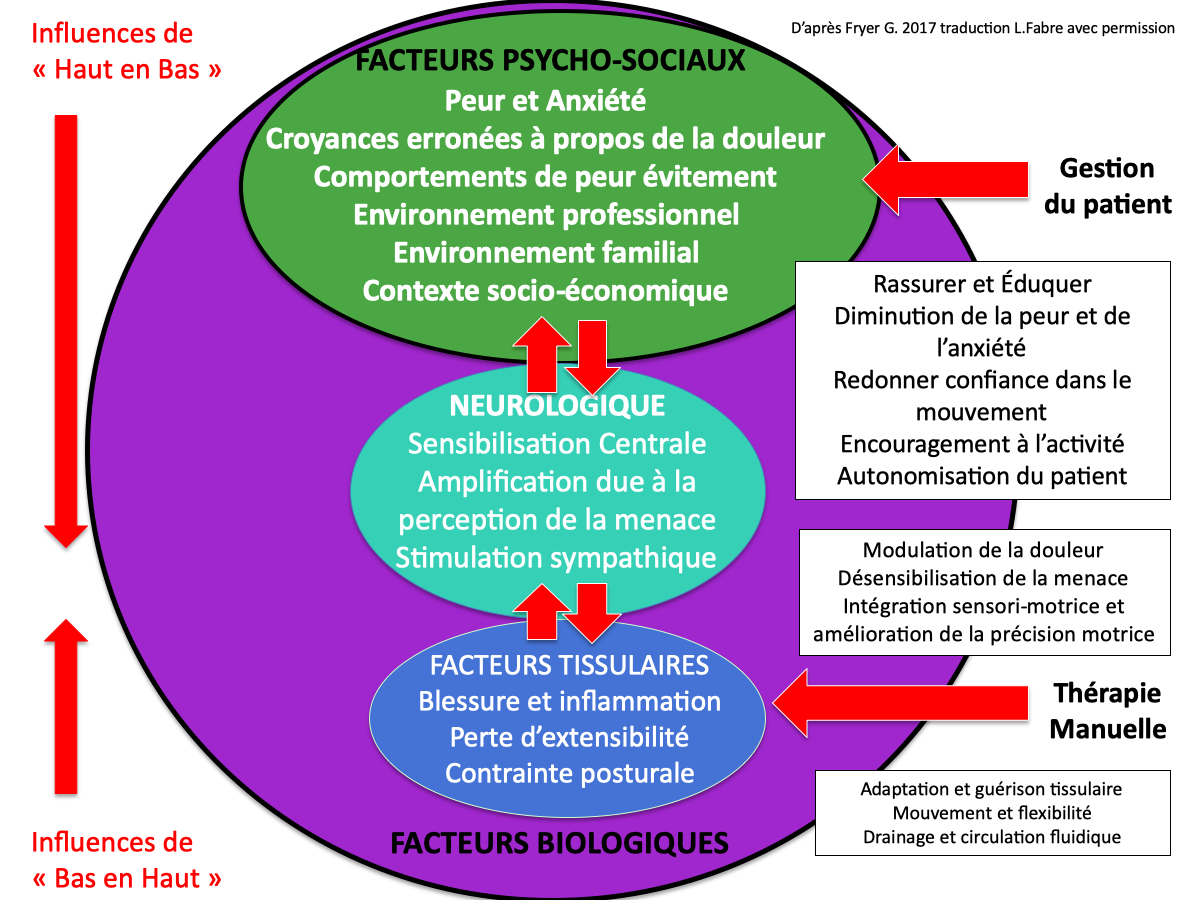
Aujourd’hui l’objectif thérapeutique de ces différentes techniques s’est recentré sur la restauration de l’homéostasie du SNP. Il est fondé sur certaines études in-vitro, in-vivo animales et humaines.
Les revues d’Ellis 2021 et de Walsh 2011, fournissent plusieurs données physiologiques intéressantes :
- Une étude in-vitro montre qu’une tension répétée de 0.1 à 1% d’étirement sur des neurones sensitifs et moteurs dans une boite de Petri permet la croissance nerveuse. Une autre étude ex-vivo chez des rats, montre que la même tension (0.1-1%) sur des ganglions de racine dorsale permet la repousse nerveuse. Par contre avec des niveaux d’étirement supérieur cela provoque de la mort neuronale.
- Sur des modèles animaux in-vivo, sur lesquels on a généré des lésions nerveuses, la mobilisation neurale diminue la secrétion de cytokines pro-inflammatoire, réduit la fibrose neurale, permet la régénération neurale et augmente la production de récepteurs opioïdes endogènes.
- La structure de l’axoplasme est celle d’un fluide de Bingham répondant à une mécanique non-newtonienne (Rubinson 1978). Ses propriétés mécaniques d’élasticité et d’écoulement dépendent de contraintes de cisaillement et déformation (un peu comme le dentifrice ou la mayonnaise). Grâces à de nouvelles techniques d’imagerie comme l’élastographie par onde de cisaillement, on peut mesurer l’indice de rigidité du nerf qui est différente sur des nerfs sains et des nerfs malades (neuropathies chimiques et mécaniques). Les techniques de neurotension semblent améliorer l’indice de rigidité du nerf.
- Enfin certaines études suggèrent que les techniques de neuroglissement pourraient participer à la dispersion des fluides et de l’oedème endoneural en cas de neuroinflammation (Schmid 2018)
L’efficacité des techniques neurodynamiques : la balance bénéfice/risque
Les bénéfices des techniques :
Plusieurs revues systématiques concluent un peu toutes la même chose : le faible niveau méthodologique de la plupart des études ne permet pas de conclure définitivement de l’efficacité des techniques neurodynamiques.
Ceci étant les données montrent que, quand on compare les échantillons à des groupes contrôles ou à un placebo, le traitement neurodynamique aide sur la diminution de la douleur et sur la récupération fonctionnelle dans les problèmes de douleur radiculaire cervical, lombaire, et dans le syndrome du canal carpien (Basson 2017, Núñez de Arenas-Arroyo 2021).
Maintenant, si on compare ces techniques uniquement à d’autres traitements de thérapie manuelle ou à de l’exercice physique, il n’y a pas de supériorité de l’efficacité des techniques neurodynamiques (Basson 2017, Su 2016) dans la prise en charge des douleurs neuropathiques.
Dans le cas du syndrome du canal carpien, les techniques neurodynamiques n’apporte aucun bénéfice à un traitement d’attelle et de mobilisation de tendons (Page 2012).
Les raisons possibles pour laquelle on ne voit pas d’efficacité propre de ces techniques, pourrait être due au fait que dans la plupart des études :
- Il ne semble pas y avoir d’indication claire sur la durée, le dosage, la fréquence ou le type de technique à utiliser (Walsh 2005);
- Il n’y a pas encore de phénotypage des patients, c’est-à-dire que l’intervention n’est pas adaptée à la bonne classification.
Pour comparaison nous pouvons prendre l’exemple de la prise en charge médicamenteuse des douleur neuropathiques par compression du nerf sciatique. Une revue systématique montre que l’efficacité des anti-inflammatoires non stéroïdiens, des corticostéroïdes, des antidépresseurs, des neurotropes, des myorelaxants et des opioïdes, n’est pas mieux que celle du placebo (Pinto 2012).
Maintenant si l’on regarde dans la méthodologie de cette revue de littérature, l’éligibilité d’inclusion des études comprenaient pour le terme ‘sciatique’ des diagnostics complètement différents : radiculopathie, douleur radiculaire, compression de racines nerveuses, douleur irradiant sous le genou…
L’utilité d’une classification ou d’un phénotypage :
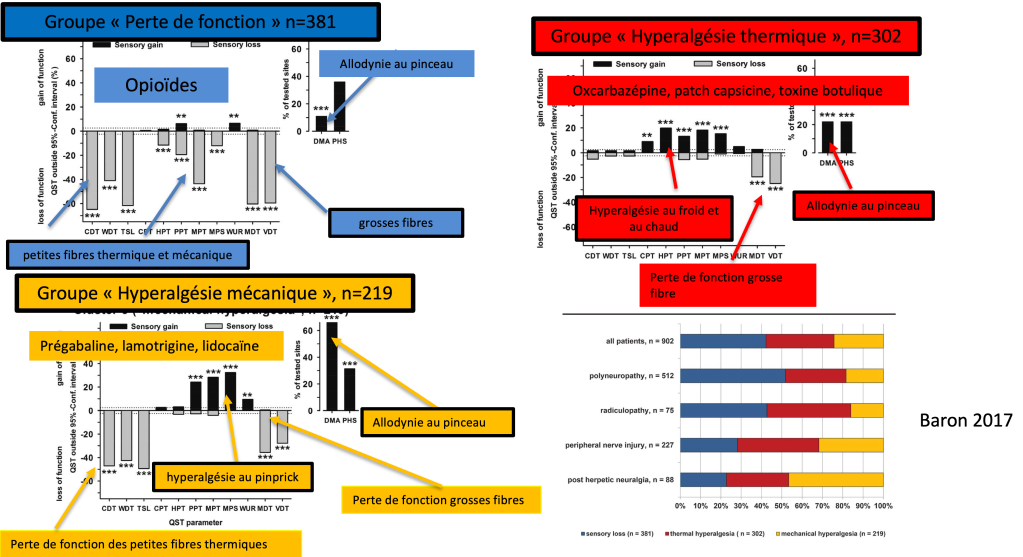
Aujourd’hui il existe un phénotypage de douleurs neuropathiques qui permettent d’adapter au mieux le type de traitement en fonction du résultat du testing quantitatif sensoriel (Baron 2017).
Ci-dessous sont présentés sur 902 patients présentant des douleurs neuropathiques, une classification en sous-groupe :
- Un groupe nommé « Groupe Perte de Fonction » pour lequel on retrouve : une perte de fonction sur les grosses fibres (seuil de détection à la vibration au pinceau) et sur les petites fibres mécaniques (seuil de détection de la douleur à la pression et à la piqure) et thermiques (détection du chaud et du froid) ;
- Un groupe nommé « Groupe Hyperalgésie Mécanique » pour lequel on retrouve : un gain de fonction sur les petites fibres mécaniques (hyperalgésiee à la piqûre, à la pression, une allodynie au pinceau et un wind-up augmenté) avec une perte de fonction sur les grosses fibres et les petites fibres thermiques ;
- Un groupe nommé « Groupe Hyperalgésie Thermique » pour lequel on retrouve : un gain de fonction sur les petites fibres thermiques (hyperalgésie au froid et au chaud) avec une perte de fonction sur les grosses fibres.
Différentes études montrent que les sous-groupes ne sont pas répondant aux mêmes médicaments : par exemple le groupe perte de fonction répond mieux aux opioïdes, le groupe hyperalgésie mécanique à la prégabaline (Lyrica), et le groupe hyperalgésie thermique à l’oxcarbazépine (Trileptal).
Concernant la thérapie manuelle, une équipe australienne a conduit une démarche similaire de création de classification à laquelle ils ont appliqué un traitement neurodynamique adapté à la classification.
Dans un premier temps ils ont proposé une sous-classification des lombalgies irradiantes dans le membre inférieur selon les mécanismes neurophysiologiques impliqués dans le problème de nerf.
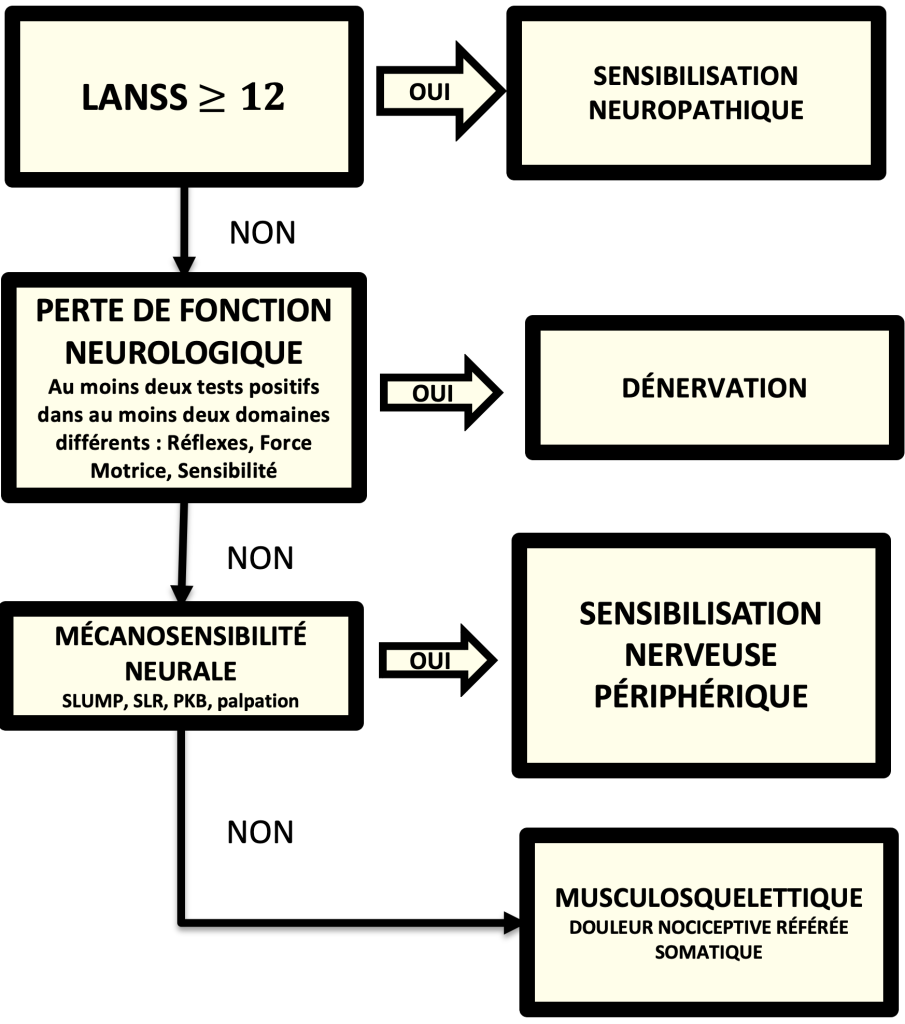
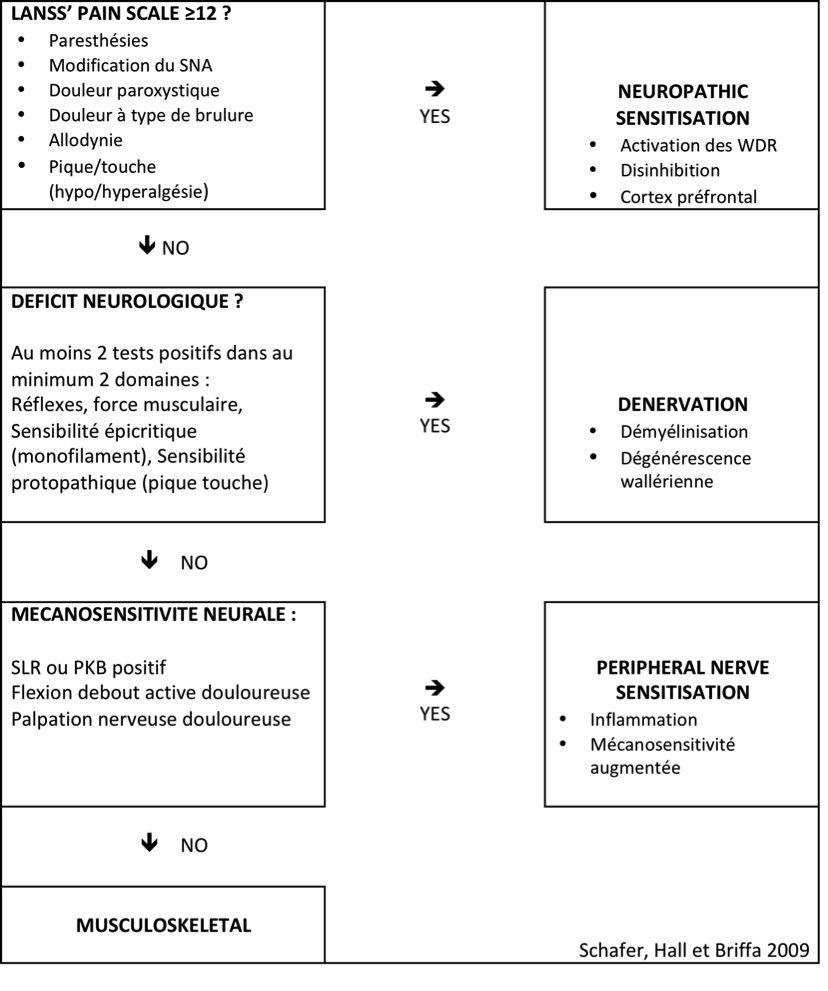
En fonction des signes et symptômes retrouvés à l’examen clinique ils ont décrit 4 groupes de patients (Schafer et al 2009 a) :
- Un groupe « Sensibilisation Neuropathique (SN) » défini par un score supérieur à 12 au LANSS (Leeds Assessment of Neuropathic Symptoms and Signs, qui est un questionnaire de dépistage de douleur neuropathique comme le DN4)
- Un groupe « Dénervation (D) » défini par une perte de fonction d’au moins 2 sur 3 tests neurologiques (Réflexe, Force Motrice, Sensibilité)
- Un groupe « Sensibilisation Nerveuse Périphérique (SNP) » défini par des tests de mécanosensibilité positifs à la provocation (SLUMP, Lasègue, Léri) et/ou à la palpation des nerfs (allodynie à la palpation des nerfs sciatique, tibial, fibulaire ou fémoral)
- Un groupe « Musculosquelettique (M) » ne répondant à aucun des critères ci-dessus et pour lesquels les tests de provocation déclenchaient une douleur référée somatique.
Ils ont ensuite soumis cette classification à 5 experts qui ont triés 40 patients pour vérifier la fiabilité de cette classification selon l’algorithme ci-dessous (Schäfer et al 2009 b) :
Après avoir démontré la fiabilité de cette classification ils ont appliqué cet algorithme pour trier 77 patients, à qui ils ont appliqué sept interventions de mobilisation neuronale deux fois par semaine, intégrant deux techniques de mobilisation passive visant la mobilisation des structures neurales dans le foramen intervertébral : une technique de mobilisation d’interface lombaire et une technique de sliding par le nerf sciatique (Schafer et al 2011).
Le principal résultat de cette étude était une réponse positive au traitement, défini comme l’obtention d’un Changement Minimal Cliniquement Important (CMCI) sur la douleur, l’incapacité et sur le changement global perçu par le patient, évalués par les questionnaires : EVA, RMDQ et GPC.
La proportion de répondeurs était significativement plus importante dans le groupe SNP (56% des patients atteignant le CMCI) que dans les trois autres groupes (NS 11%, p=0,02 ; D 15%, p=0,026 et M 11%, p = 0,016).

Il semble donc que ce ne sont pas les techniques neurodynamiques qui soient efficaces mais bien leur utilisation au sein d’une classification basée sur les mécanismes neurophysiologiques impliqués dans le problème de nerf.
Les risques potentiels de la neurotension
Dans le cas des douleurs neuropathiques les techniques de neurotension seraient susceptibles d’aggraver la situation.
Tout d’abord on sait que ces tests déclenchent des douleurs et des paresthésies chez des personnes asymptomatiques (Coppieters 2001).
D’autre part plusieurs revues montrent que la mise en tension des racines nerveuses est délétère et pourrait être source de radiculopathie et de douleur neuropathique (Kitab 2009, Berthelot 2018).
Différentes études physiologiques animales montrent aussi que la mise en tension des racines et des nerfs, qu’elle soit maintenue (Haftek 1970, Kwan 1992, Lundborg 1973, Ogata 1986) ou répétée (Watanabe 2001), diminue la perfusion du nerf, et entraine un défaut de conduction.
D’autres études in vivo montrent les mêmes conséquences sur les racines lombaires par mise en tension du nerf sciatique (Takamori 2011) ou sur la mise en tension du nerf médian chez les personnes atteintes du canal carpien (Ginanneschi 2015).
Les enregistrements électriques in vitro et in vivo montrent des décharges ectopiques suite à l’étirement physiologique ou la compression de nerfs inflammés (Bove 2003, Dilley et Lynn 2004, Greening 2005), « qui pourraient conduire à une cascade de changements au sein du système nerveux central, dont certains peuvent entraîner de la douleur chronique » (Greening 2007)
Pour mettre en perspective ce risque il convient de dire que ces effets délétères dépendent des caractéristiques de la mise en tension, telles que l’allongement, la durée, la charge et la fréquence et du tissu nerveux (et qu’il n’existe quasiment aucune preuve clinique de bon dosage !!!!).
Sont détaillés ci-dessous les résultats d’études que vous retrouverez dans les articles de Walsh 2005, Berthelot 2018 et d’Ellis et al 2021, :
- Chez les animaux en fonction des nerfs un étirement au-delà de 6 à 8 % de la longueur du nerf, entraine une diminution de perfusion avec perte de conduction, entre 11 à 18%, l’occlusion est complète;
- 3 à 5 % d’étirement suffisent à déclencher de la mécanosensibilité d’un nerf inflammé sur des modèles animaux;
- Le nerf médian se déchire à partir de 20% d’étirement.
- Après 2 à 11 minutes d’occlusion l’enregistrement EMG montrent que les muscles autour des nerfs deviennent irritables.
- En fonction du temps de mise en tension prolongée certaines pertes de fonction peuvent être irrécupérable (12% d’étirement pendant 50 minutes, faut le vouloir !!!)
- Les pertes de fonction enregistrées apparaissent après la répétition de traction (60-120 cycle/heure, faut vraiment le vouloir !!! ).
Si on compare les valeurs de tension à la vraie vie de tous les jours :
- Une abduction d’épaule 180° provoque un étirement du plexus brachial de 3 à 23% en fonction des personnes;
- Certains mouvements combinés du membre supérieur exposeront les nerfs médian, radial et ulnaire à une tension respective de 18%, 12% et 10%;
- Se pencher en avant tend le nerf sciatique de 10,5%, un test de Lasègue (SLR) tend le nerf sciatique de 12 %
En prenant du recul sur le fait que les mesures sont faites soit sur des animaux soit sur des cadavres, et que les tissus vivants n’ont pas vraiment la même compliance (Ma et al 2013), on constate tout de même que certains mouvements sont dans des limites de mise en contrainte dommageable pour les nerfs.
Mais surtout on a aucun moyen dans la vie de tous les jours ni dans l’examen clinique de déterminer l’importance de la tension du nerf.
L’application pratique de ces informations est que :
Les tests de provocation, doivent être mis en place avec prudence, douceur et lenteur en ayant le feedback continuel du patient sur ce qu’il ressent (douleur, paresthésies…) car le clinicien n’a aucun moyen valide de déterminer le pourcentage de mise en tension exacte ;
Les techniques de neurotension doivent être encadrées d’une évaluation et d’un suivi régulier de la fonction système nerveux périphérique pour vérifier que l’homéostasie du SNP est respectée.
En conclusion …
Les techniques neurodynamiques avec l’application d’une tension optimale favoriseraient l’homéostasie du nerf.
Il n’y a pas d’études qui soutiennent le dosage approprié (durée, fréquence ou amplitude) dans l’application des techniques, ce qui laisse seul le clinicien déterminer ces paramètres.
L’utilisation de ces techniques sans classification n’est pas mieux que faire n’importe quelle autre technique ou exercice.
Quand le nerf est mécanosensible les techniques de neurotension sont contre-indiquées.
Les techniques de neurotension ont un risque d’aggravation qui dépend du pourcentage d’étirement du nerf, lui-même ne pouvant pas être déterminer cliniquement.
L’évaluation de la fonction (examen neurologique avec testing quantitatif sensoriel) doit être suivi régulièrement tout au long du traitement si on décide d’utiliser ces techniques.
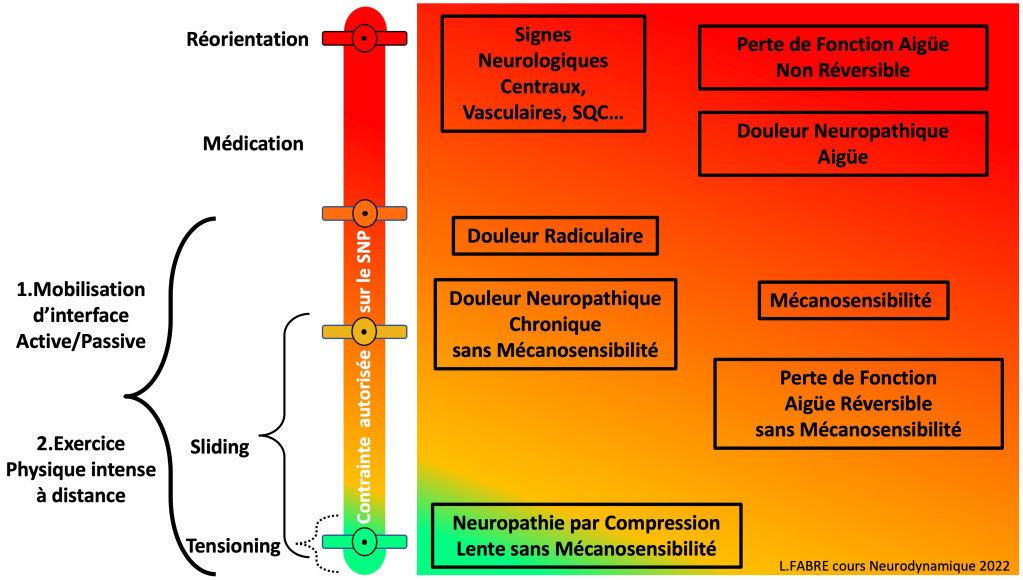
PS : Il y a forcément un biais de sélections et d’interprétation dans cet article étant donné que j’ai retiré les techniques de neurotension dans ma pratique, jugeant la balance bénéfices/risques défavorable.
Ceci étant voici à titre d’indication en fonction des situations cliniques quelles seraient les techniques les plus appropriées :
Bibliographie
Balster SM, Jull GA. (1997) Upper trapezius muscle activity during the brachial plexus tension test in asymptomatic subjects. Man Ther.
Basson A et al (2017). The effectiveness of neural mobilization for neuromusculoskeletal conditions: a systematic review and meta-analysis. J Orthop Sports Phys Ther
Bove GM et al. (2003) Inflammation induces ectopic mechanical sensitivity in axons of nociceptors innervating deep tissues. Journal of Neurophysiology
Dilley A, Lynn B. (2004) Stretch responses of axons in regions of local inflammation in rat peripheral nerves. Comparative Biochemistry and Physiology A-Molecular and Intergrative Physiology
Coppieters MW, Stappaerts KH, Everaert DG, Staes FF.(1999) A qualitative assessment of shoulder girdle elevation during upper limb tension test 1. Man Ther.
Coppieters MW et al (2001) Addition of Test Components During Neurodynamic testing:Effect on Range of Motion and Sensory Responses. J Orthop Sports Phys Ther.
Coppieters MWet al. (2005) The impact of neurodynamic testing on the perception of experimentally induced muscle pain. Man Ther.
Coppieters MW et al. (2006). An experimental pain model to investigate the specificity of the neurodynamic test for the median nerve in the differential diagnosis of hand symptoms. Arch Phys Med Rehabi.
Coppieters MW, Butler DS. (2008) Do ‘sliders’ slide and ‘tensioners’ tension? An analysis of neurodynamic techniques and considerations regarding their application. Man Ther.
Coppieters M, and Nee RJ. (2015) Neurodynamic management of the peripheral nervous system. In:Jull G, Moore A, and Falla D, et al. editors. Grieve’s Modern Musculoskeletal Physiotherapy. 4th ed Elsevier.
Ellis R et al. (2021). Neurodynamics: is tension contentious? J Man Manip Ther.
Ginanneschi F et al. (2015) Sensory axons excitability changes in carpal tunnel syndrome after neural mobilization. Neurol Sci.
Greening J, Dilley A, Lynn B. (2005) In vivo study of nerve movement and mechanosensitivity of the median nerve in whiplash and non- specific arm pain patients. Pain.
Haftek J. (1970) Stretch injury of peripheral nerve: acute effects of stretching on rabbit nerve. J Bone Joint Surg Br. 1970
Hall T, Zusman M, Elvey R, (1998) Adverse mechanical tension in the nervous system? Analysis of straight leg raise.Manual Therapy.
Kitab SA, Miele VJ, Lavelle WF, et al. (2009) Pathoanatomic basis for stretch-induced lumbar nerve root injury with a review of the literature. Neurosurgery
Kwan M, et al. (1992) Strain, stress, and stretch of peripheral nerve: rabbit experiments in vitro and in vivo. Acta Orthop Scand.
Lundborg G, Rydevik B. (1973) Effects of stretching the tibial nerve of the rabbit. A preliminary study of the intraneural circulation and the barrier function of the perineurium. J Bone Joint Surg Br.
Ma Z, et al 2013 In vitro and in vivo mechanical properties of human ulnar and median nerves. J Biomed Mater Res A.
Ogata K, Naito M (1986) Blood flow of peripheral nerve effects of dissection, stretching and compression. J Hand Surg Br.
Page M, O’Connor D, Pitt V, et al. (2012) Exercise and mobilisation interventions for carpal tunnel syndrome Cochrane Database Syst Rev.
Rubinson KA, Baker PF(1979) The flow properties of axoplasm in a defined chemical environment: influence of anions and calcium. Proc R Soc Lond B Biol Sci.
Schäfer A et al. (2009a) Classification of low back- related leg pain—a proposed patho-mechanism-based approach. Man Ther.
Schäfer A et al. (2009b) Interrater reliability of a new classification system for patients with low back related leg pain. J Man Manip Ther.
Schafer A et al. (2011) Outcomes differ between subgroups of patients with low back and leg pain following neural manual therapy: a prospective cohort study. Eur Spine J.
Schmid AB, Hailey L, Tampin B. (2018) Entrapment Neuropathies: Challenging Common Beliefs With Novel Evidence. J Orthop Sports Phys Ther.
Su Y, Lim ECW. (2016) Does Evidence Support the Use of Neural Tissue Management to Reduce Pain and Disability in Nerve-related Chronic Musculoskeletal Pain? The Clinical Journal of Pain.
Takamori Y, Arimizu J, Izaki T, Naito M, Kobayashi T. (2011) Combined measurement of nerve root blood flow and electrophysiological values: intraoperative straight-leg-raising test for lumbar disc herniation. Spine
vanderHeide B, Allison G, Zusman M. (2001) Pain and muscular responses to a neural tissue provocation test in the upper limb. Man Ther.
Walsh M. (2005) Upper limb neural tension testing and mobilization: fact, fiction, and practical approach. J Hand Ther.
Walsh MT. (2011) Interventions in the disturbances in the motor and sensory environment. J Hand Ther.
Watanabe M et al (2001) The implication of repeated versus continuous strain on nerve function in a rat forelimb model. J Hand Surg Am.
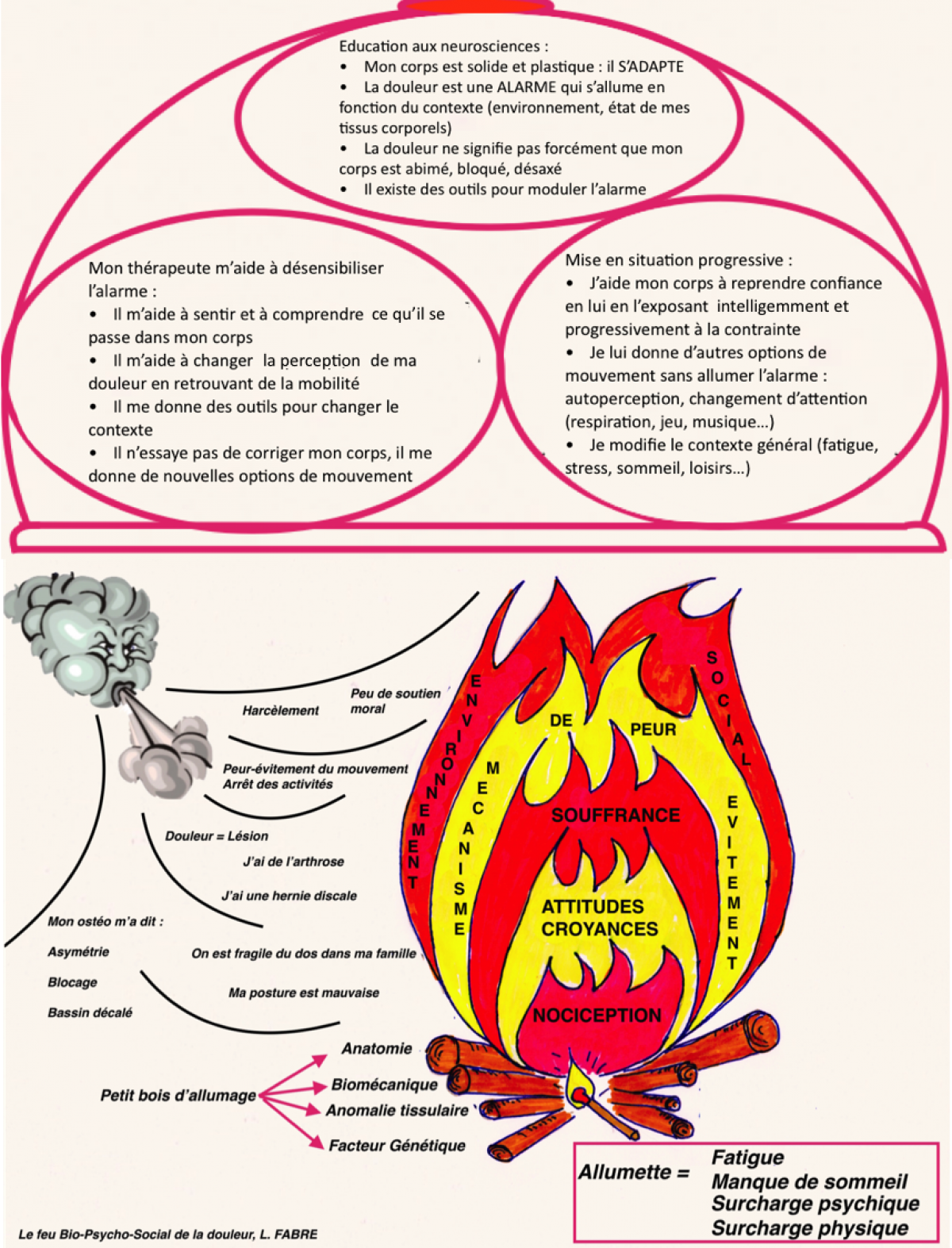





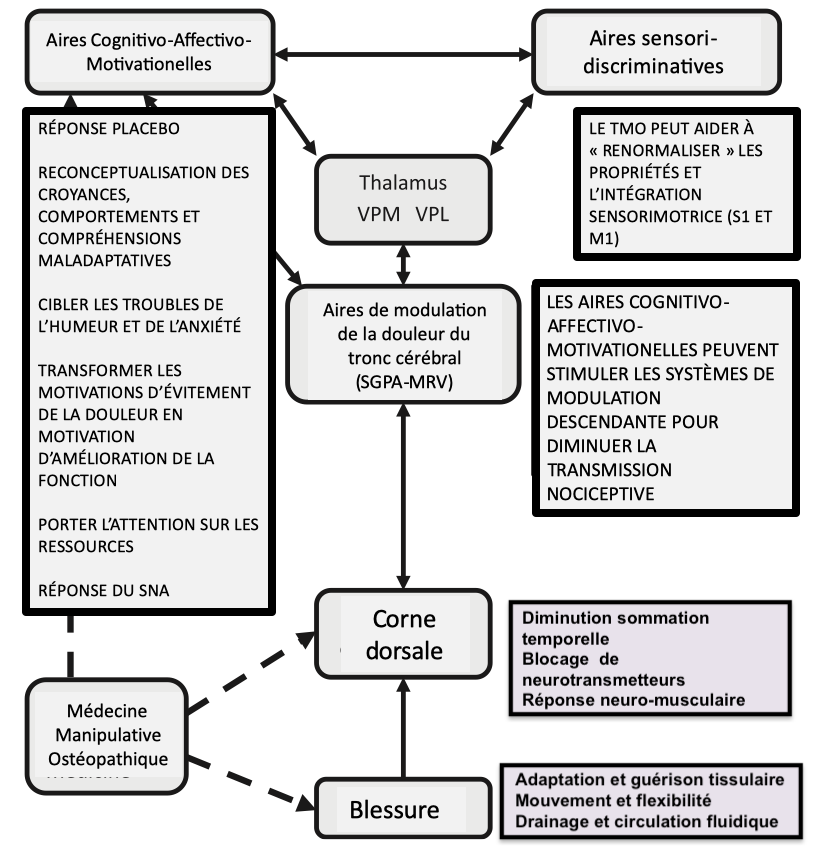

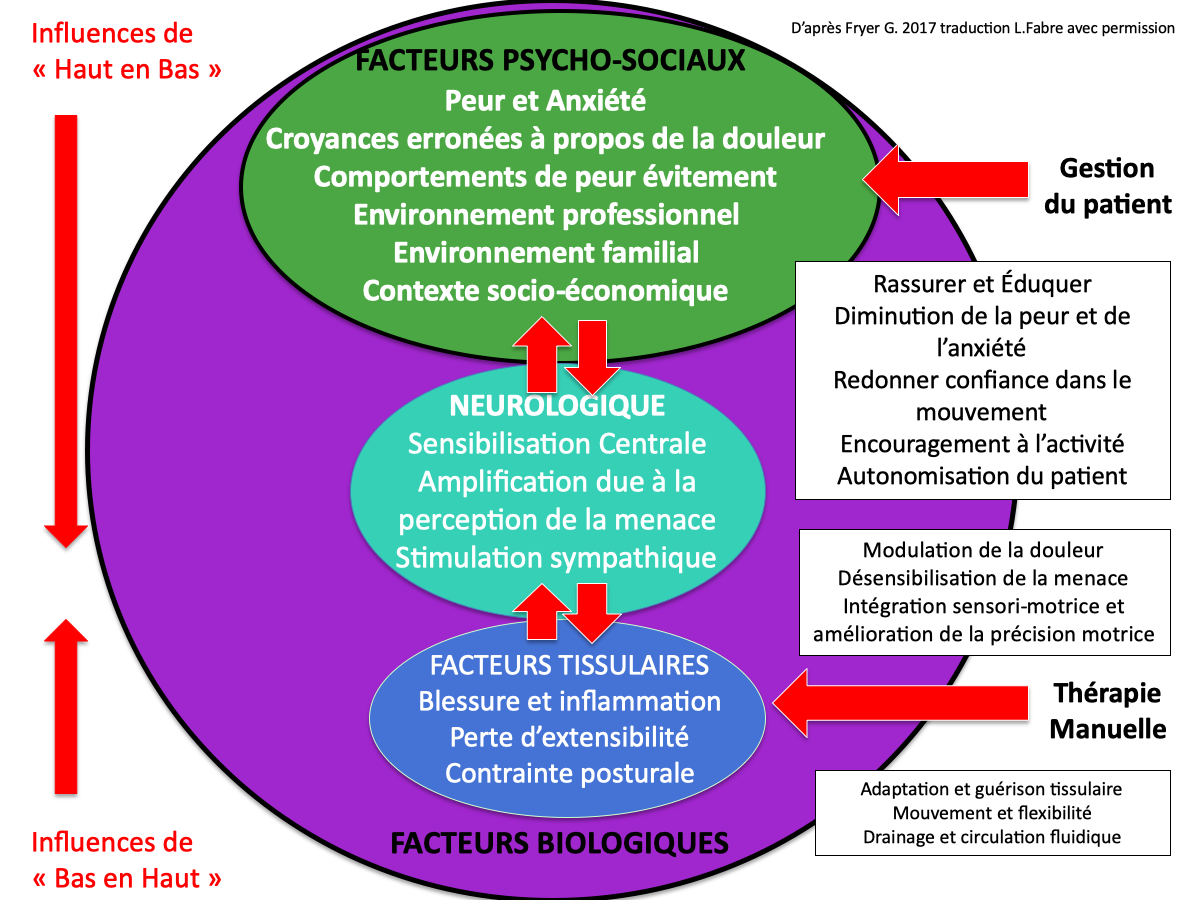

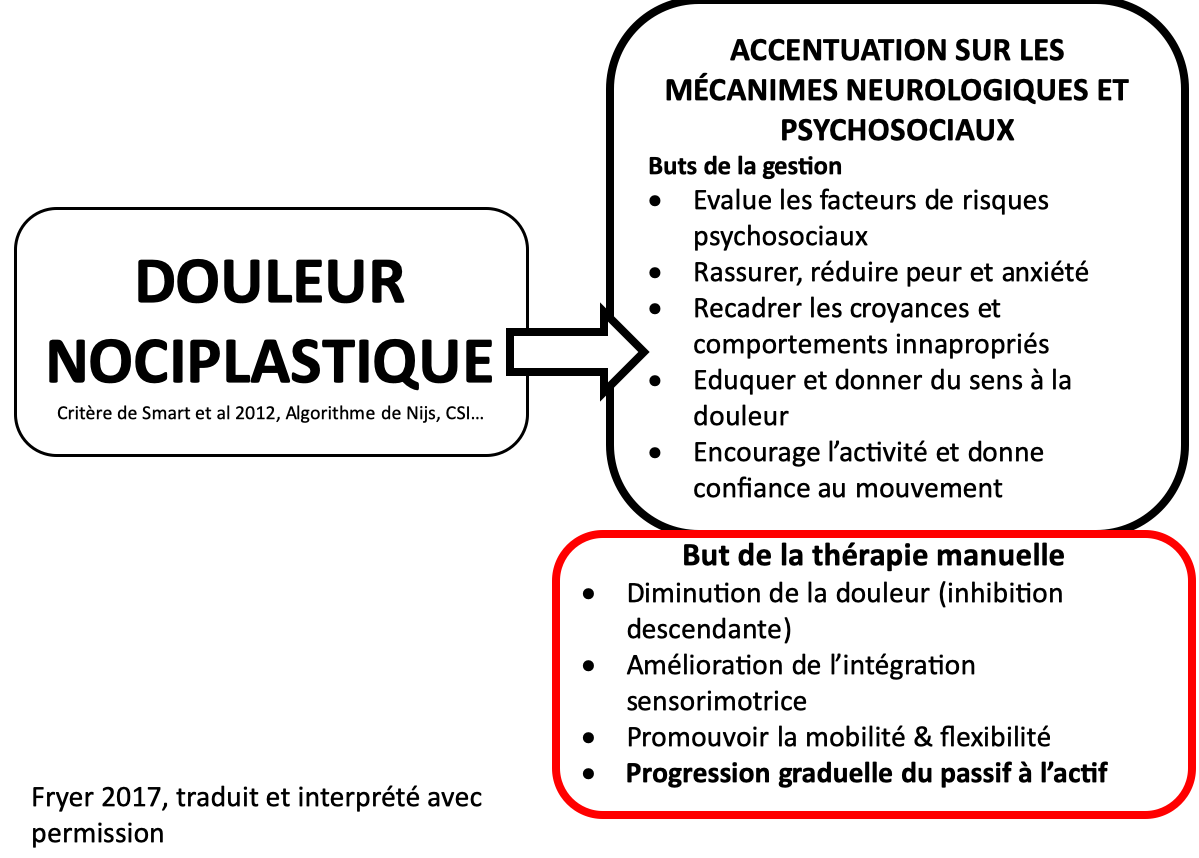
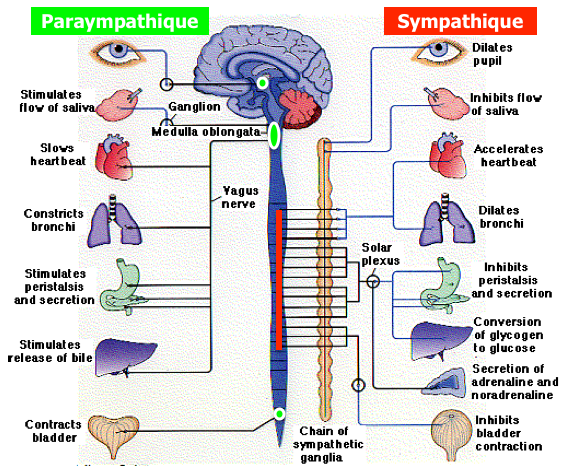











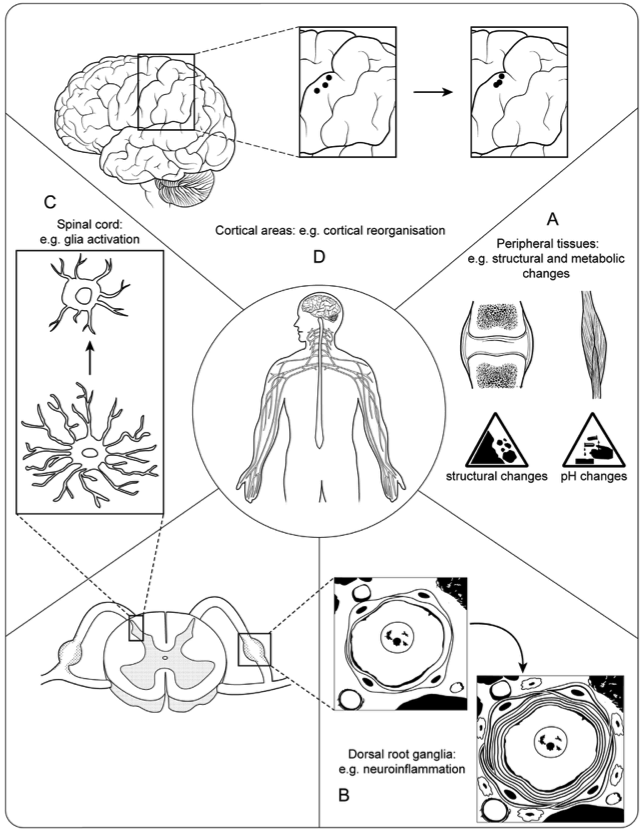

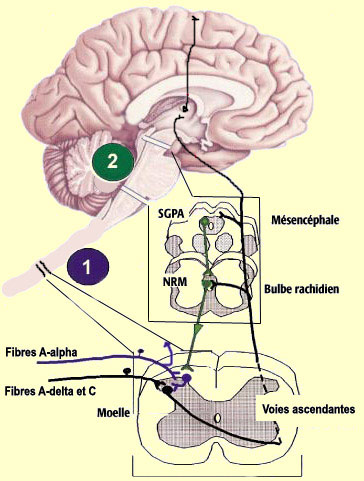
 La moëlle épinière fait partie intégrante du système nerveux central. Elle peut être considérée de façon simple comme la « queue du cerveau » qui descend dans le corps.
La moëlle épinière fait partie intégrante du système nerveux central. Elle peut être considérée de façon simple comme la « queue du cerveau » qui descend dans le corps.
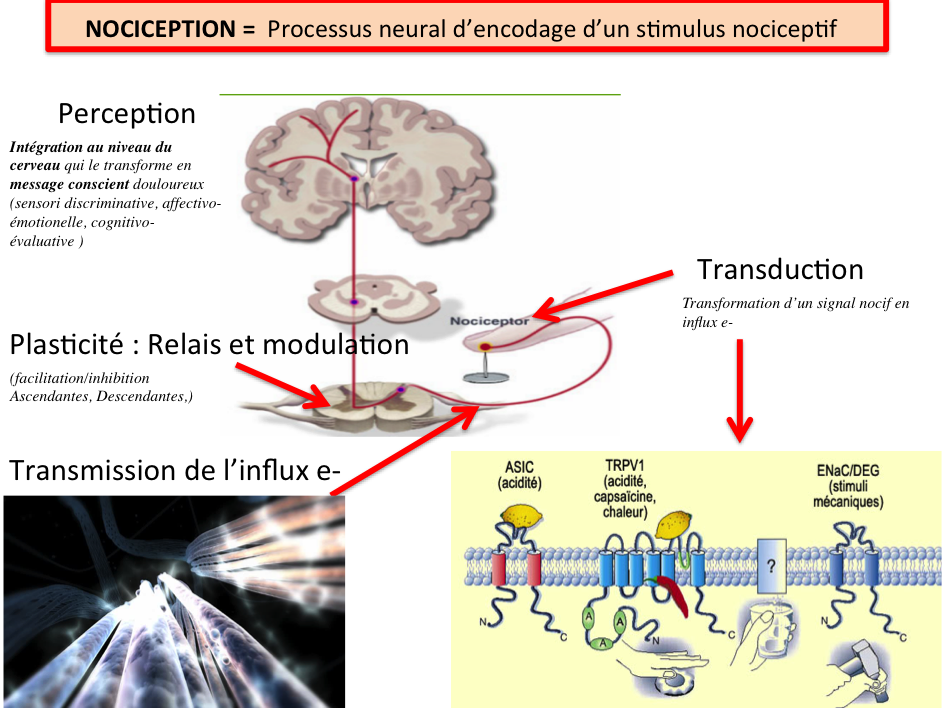

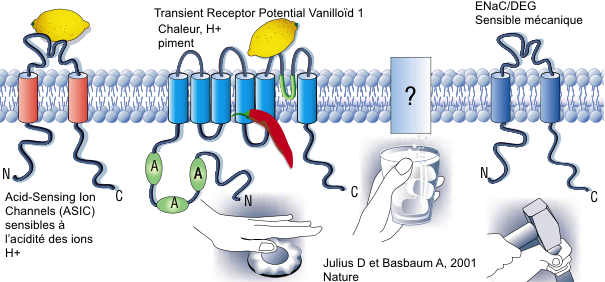
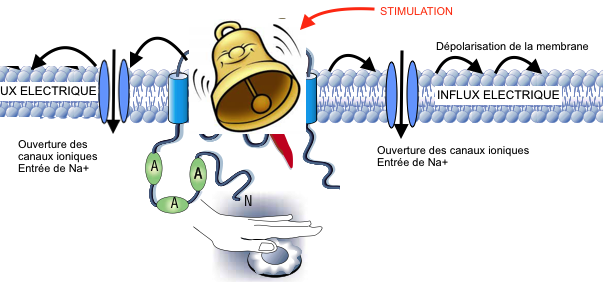
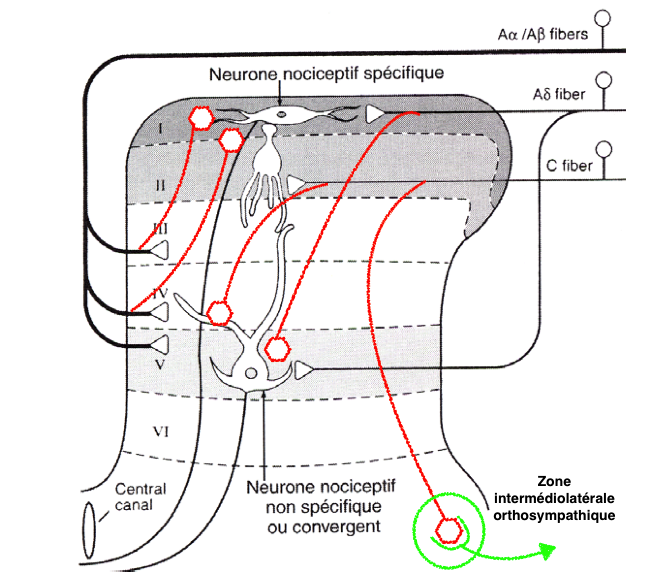
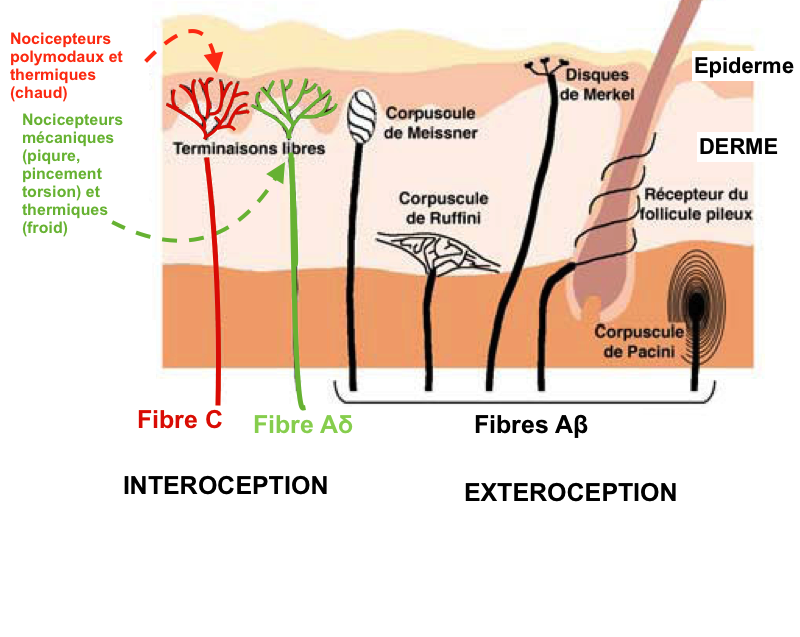 Ces fibres sont peu ou pas myélinisées et de petit calibre. La vitesse de transmission est beaucoup plus lente (0,5 à 40 m/s) que celle des fibres Aα (80-120m/s) qui véhiculent la proprioception ou les Aβ (40-90m/s) qui véhiculent le tact fin :
Ces fibres sont peu ou pas myélinisées et de petit calibre. La vitesse de transmission est beaucoup plus lente (0,5 à 40 m/s) que celle des fibres Aα (80-120m/s) qui véhiculent la proprioception ou les Aβ (40-90m/s) qui véhiculent le tact fin :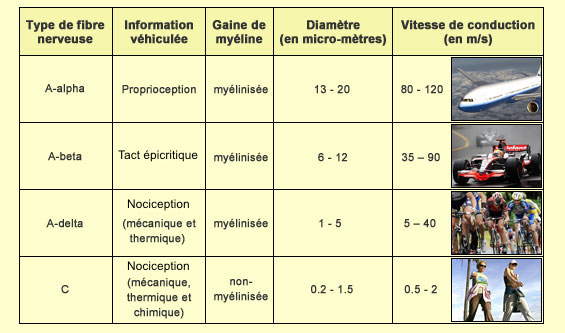
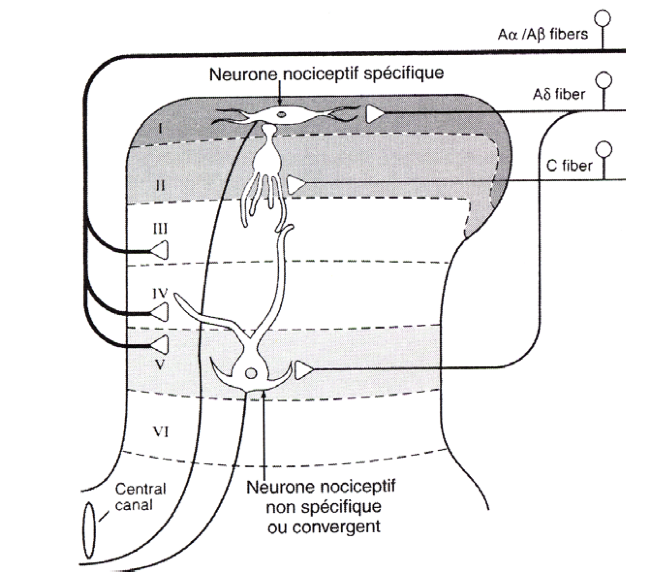
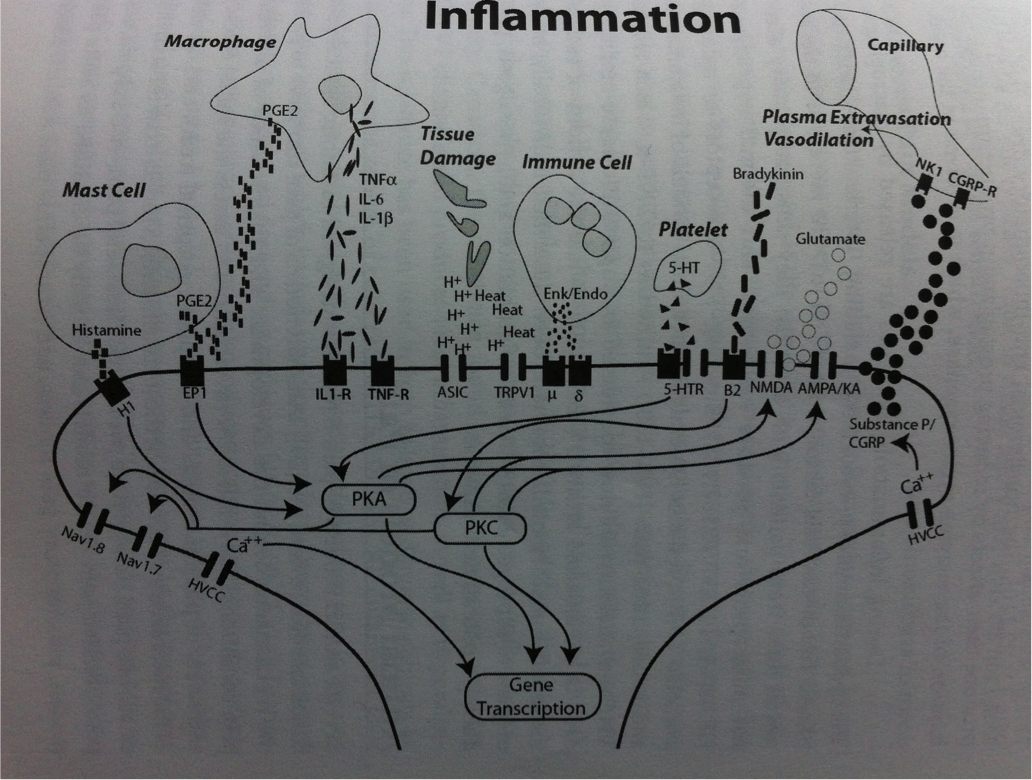
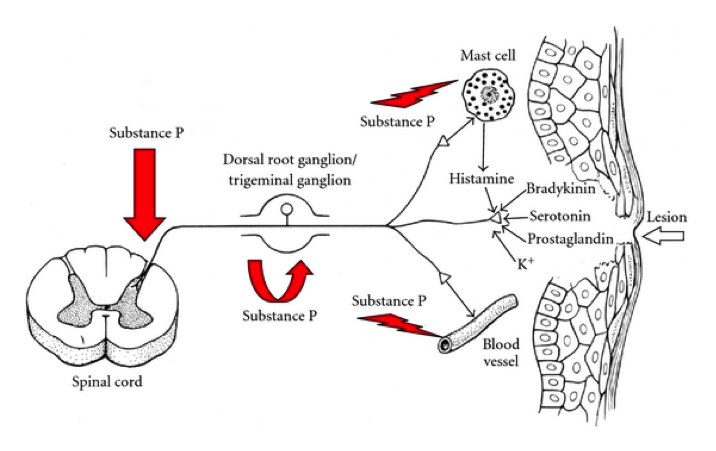
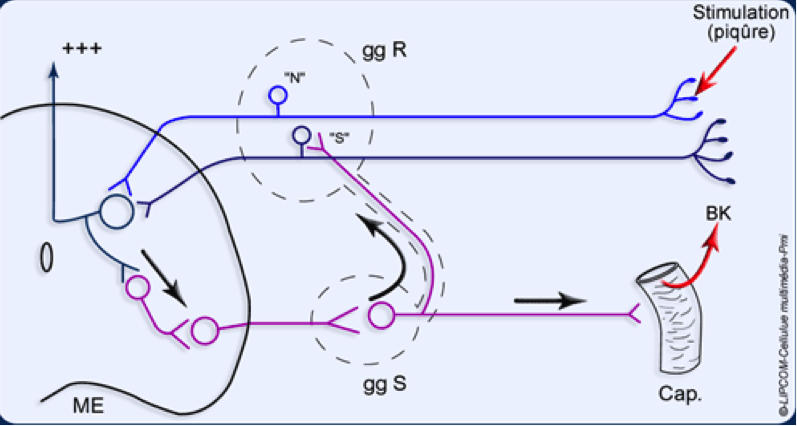
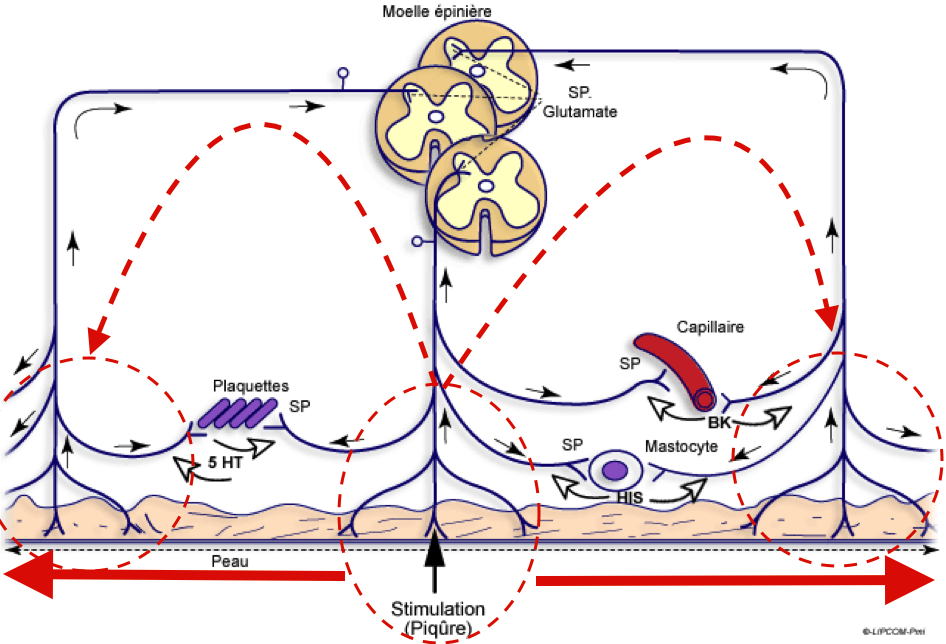
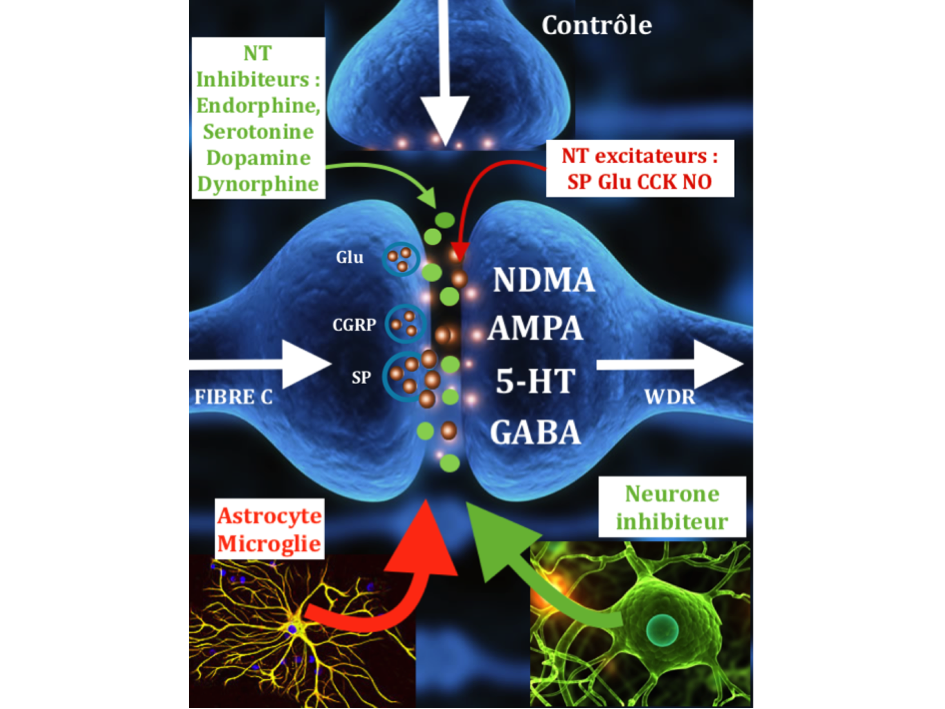

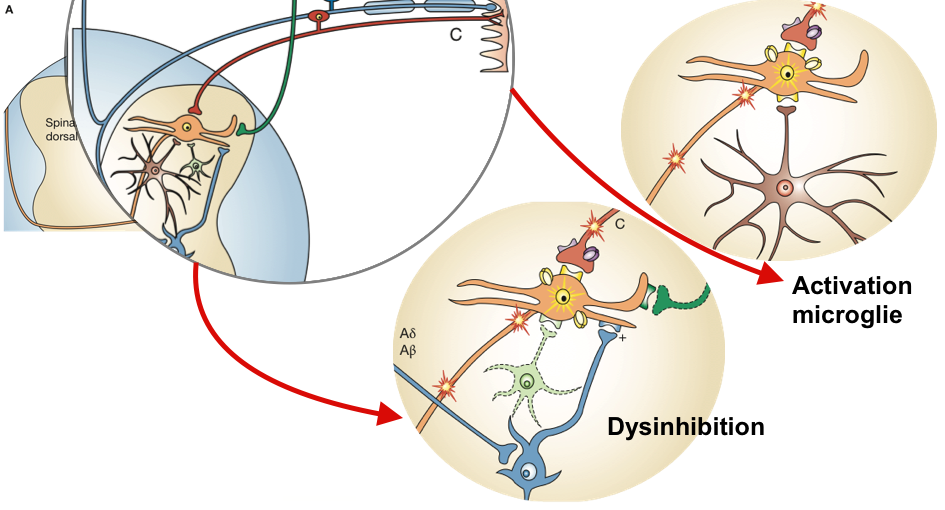
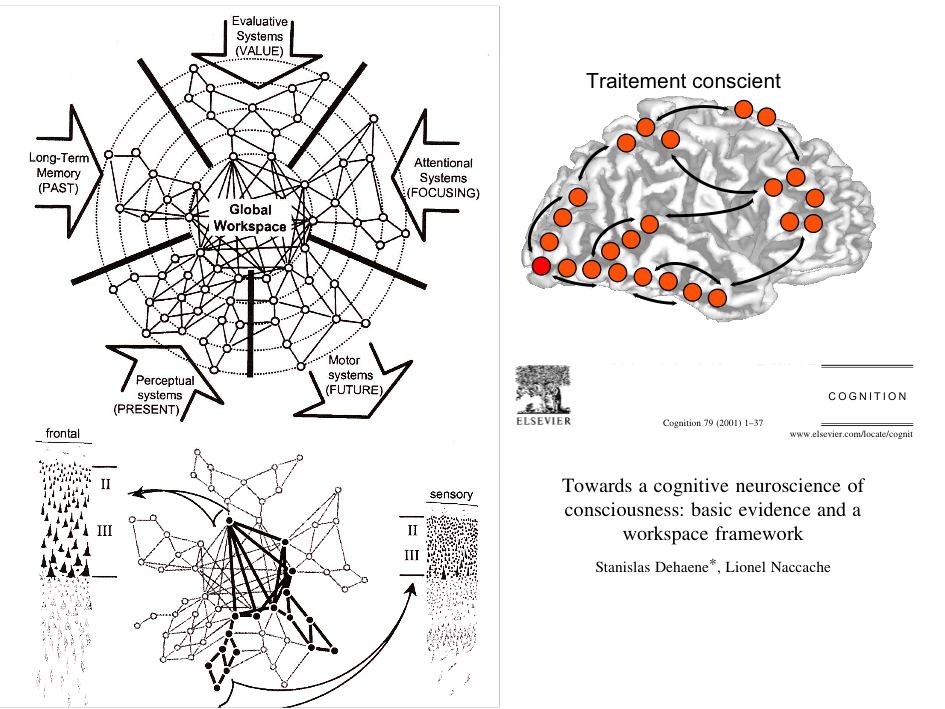
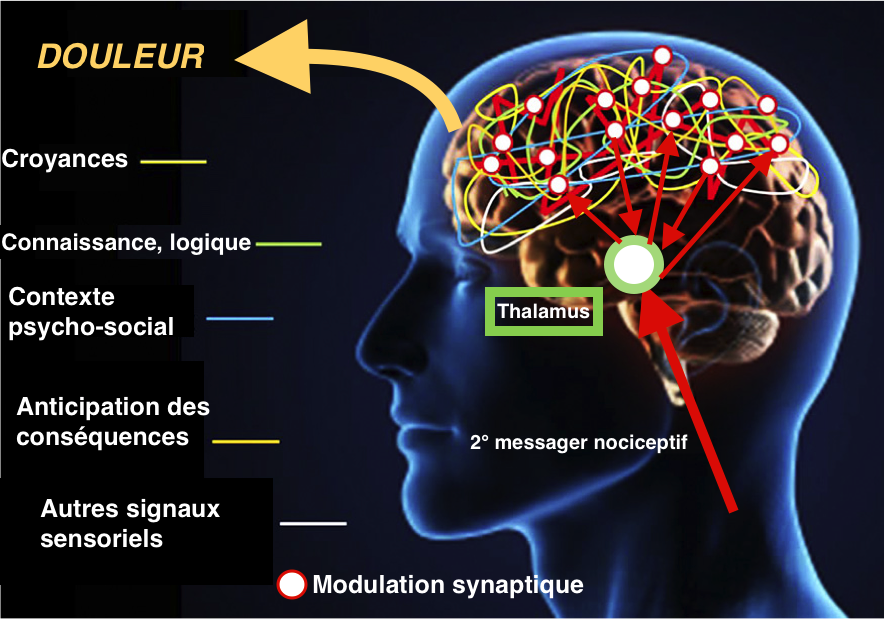
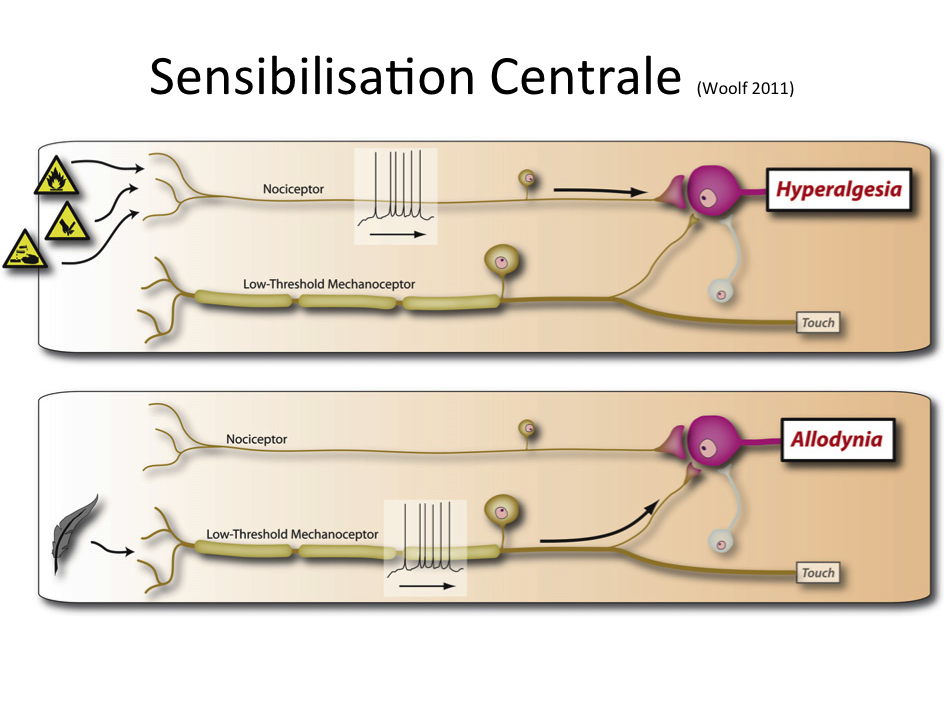 Si la majeure partie de la littérature se concentre sur les changements physiologiques dans la moelle épinière, il a également été démontré des changements de traitement sensoriel supra-spinale avec des augmentations de l’activité cérébrale dans le cortex cingulaire antérieur, l’insula et le cortex préfrontal.
Si la majeure partie de la littérature se concentre sur les changements physiologiques dans la moelle épinière, il a également été démontré des changements de traitement sensoriel supra-spinale avec des augmentations de l’activité cérébrale dans le cortex cingulaire antérieur, l’insula et le cortex préfrontal.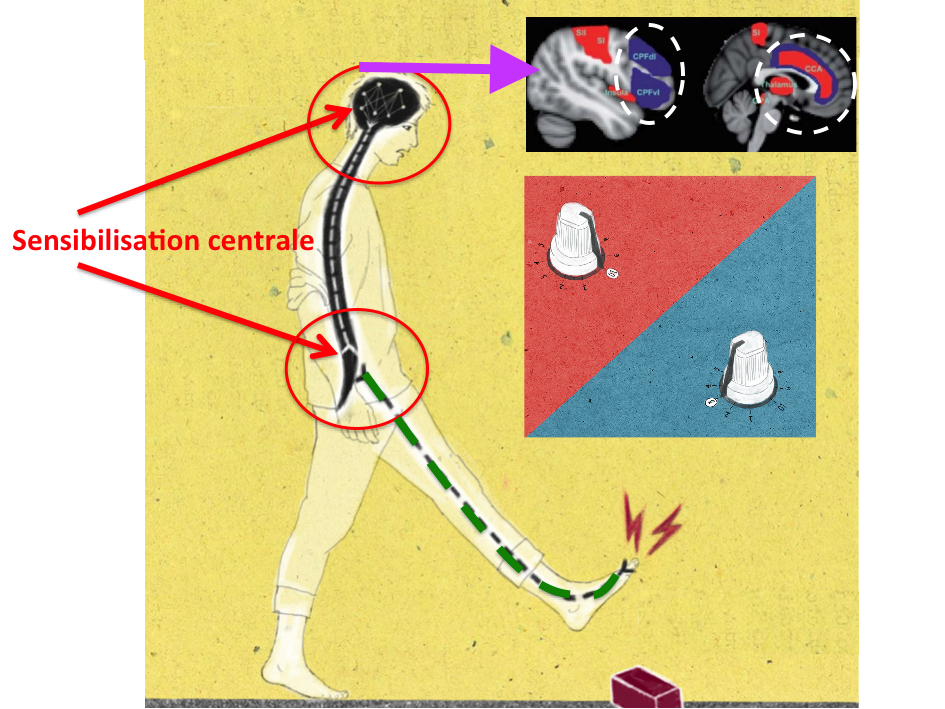




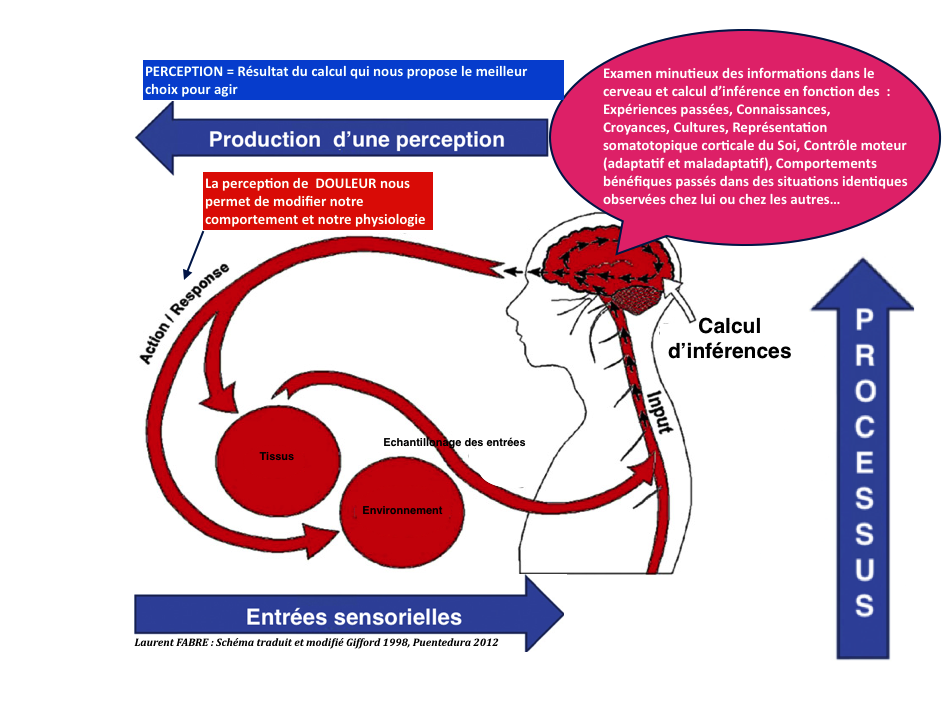

 Cette affirmation semble si simple, mais est trop souvent oubliée en pratique au cabinet quand nous gérons la douleur d’un patient.
Cette affirmation semble si simple, mais est trop souvent oubliée en pratique au cabinet quand nous gérons la douleur d’un patient.